DE PROGRAMMEERBARE PLANTENKAS // DE WERKING VAN DE GLASELEKTRODE VAN EEN PH-SENSOR

Kant-en-klare en zelf gemaakte pH-meters maken gebruik van glaselektroden. Glaselektroden zijn gemaakt van speciaal glas dat reageert op waterstofionen. Afhankelijk van de zuurtegraad van de vloeistof waarin een glaselektroden wordt gestopt ontstaat er door verschillende natuurkundige en scheikundige processen een positief of negatief elektrisch signaal. In dit artikel leggen we uit hoe een glaselektroden precies werkt, waardoor het programmeren van en werken met digitale pH-meters vaak een stuk makkelijker is.
De onderdelen van een pH sensor
Een pH-sensor bestaat uit een langwerpige buis met aan de bovenkant een kabel die wordt aangesloten op een speciale data-logger of op een zelf te programmeren microcontroller, zoals een Arduino UNO. Aan de onderkant van de pH-sensor zit een stukje glas, meestal in de vorm van een bol, maar soms ook in de vorm van een potloodpunt. Dit stukje glas is niet zomaar glas, maar glas dat gevoelig is voor waterstofionen.
Wanneer je goed naar een pH-sensor kijkt, dan zie je dat er van binnen twee zilverkleurige draadjes zitten. Deze draadjes zijn de elektroden. Ze zijn meestal gemaakt van zilver en zilverchloride. De elektrode die meer aan de buitenkant zit heet de referentie elektrode, en elektrode die meer aan de binnenkant zit wordt de interne elektrode of de glaselektrode genoemd.
Rondom de twee elektroden zit een vloeistof. De referentie elektrode is omringd met een kaliumchloride-oplossing, die uit kalium-ionen en chloride-ionen bestaat. Rondom de interne elektrode zit ook een kaliumchloride-oplossing, maar in dit geval is deze met behulp van een bufferoplossing tot een pH van 7,0 pH gebracht.
Het laatste onderdeel van de pH-sensor dat van belang is, is het poreuze referentiepunt. Deze doet dienst als een zoutbrug. De plaats en het materiaal van de zoutbrug verschilt per pH sensor.
Het glas van de glaselektrode
Het glas van het uiteinde van de pH-sensor bestaat uit drie lagen. Aan de binnenkant van het glas bevindt zich de interne gel laag. Deze laag staat in contact met de interne vloeistof, die uit een oplossing van kaliumchloride bestaat die met behulp van een buffer naar een pH-waarde van 7,0 pH is gebracht. De interne gel laag wordt gevormd doordat waterstofmoleculen in de interne vloeistof waterstofbruggen vormen met de negatieve zuurstofionen die aan de buitenkant van het glas zitten.
De binnenste laag is een harde glas laag. Deze laag bestaat uit silicaationen die niet kunnen bewegen. In deze laag zitten ook natrium ionen die als het ware los in de harde glas laag zitten, waardoor ze in deze laag kunnen bewegen.
Ten slotte zit aan de buitenkant van het glas de externe gel laag. Deze laag staat in contact met de te testen vloeistof. Ook deze laag is ontstaan door waterstofbruggen te vormen met de watermoleculen in de bewaarvloeistof of met de waterstofmoleculen in de test vloeistof.
De interne gel laag en de externe gel laag zijn een soort overgangsfase tussen het glas en de interne vloeistof of de test vloeistof. Zodra het glas van de pH-sensor uitdroogt, dan verdwijnen de gel lagen. In theorie komen de gel lagen weer terug zodra de pH-sensor weer voor een lange tijd in een vloeistof wordt legt. In de praktijk blijkt dat pH-sensoren die uitgedroogd zijn en daarna weer gehydrateerd worden het vaak slechte doen. De sensoren werken dan meestal veel langzamer en zijn vaak minder accuraat. Het is daarom belangrijk om het glazen uiteinde van de pH-sensor niet te laten uitdrogen en altijd in een speciale bewaarvloeistof te bewaren.
De werking van een pH-sensor
Wanneer we de pH-waarde van iets willen weten, willen we eigenlijk weten hoeveel waterstofionen er in een vloeistof zitten. Het enige deel van de pH-sensor dat verandert naarmate er minder of meer waterstofionen in een vloeistof zitten, is het glas van de pH-sensor. Zoals eerder gezegd bestaat dit glas uit een interne gel laag, die in contact staat met de interne vloeistof, de harde glas laag, en de externe gel laag, die in contact staat met de test vloeistof. Afhankelijk van hoeveel waterstofionen er in de test vloeistof zitten, wordt er een kettingreactie op gang gebracht die er voor zorgt dat er meer of minder elektrische spanning gemeten wordt door de data-logger of de microcontroller.
De pH-sensor in Een zure test vloeistof
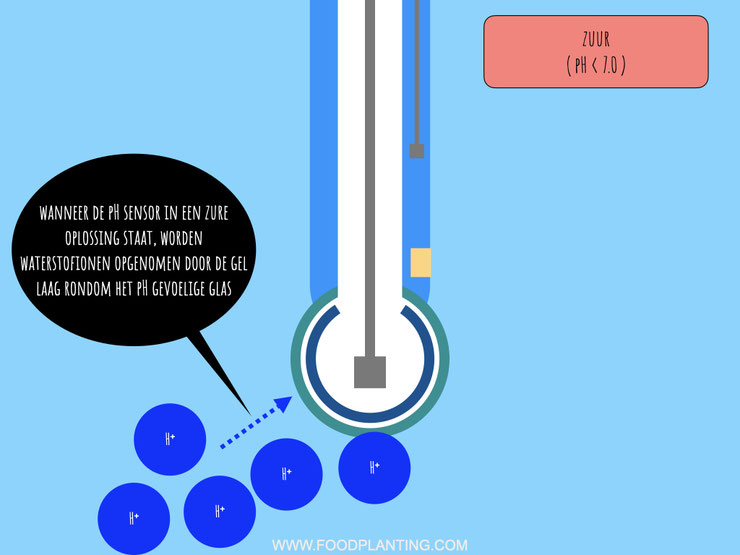
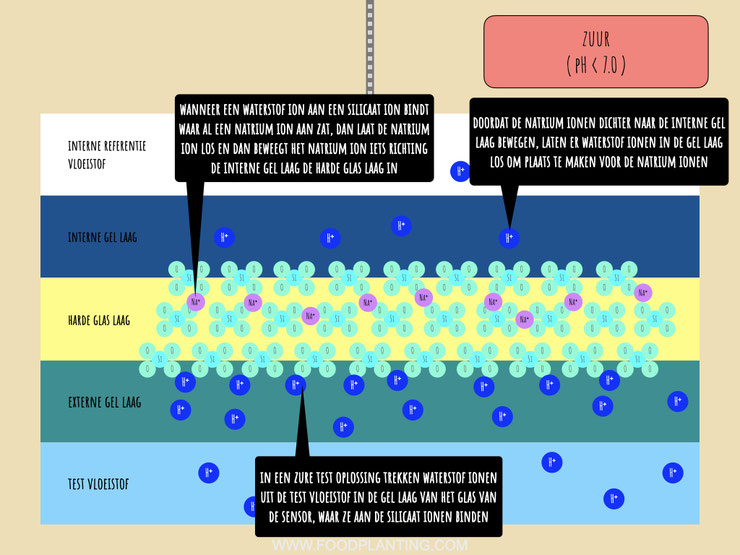
De eerste stap in de kettingreactie van de pH-sensor in een zure test vloeistof begint bij de externe gel laag. Wanneer de test vloeistof zuur is, en dus veel waterstofionen bevat, dan zitten er in de test vloeistof meer waterstofionen dan dat er waterstofionen, of andere enkelvoudig positief geladen ionen, in de externe gel laag zitten. Het gevolg hiervan is dat de waterstofionen uit de test vloeistof de externe gel laag in stromen en aan de negatief geladen zuurstofdeeltjes aan de buitenkant van het glas binden. Mochten er al andere ionen dan waterstofionen aan de zuurstofdeeltjes gehecht zijn aan het glas, dan stoten de waterstofionen deze weg zodat er zelf kunnen gaan zitten. Van alle positief geladen ionen hebben waterstofionen namelijk de sterkste aantrekkingskracht, waardoor ze het van andere deeltjes “winnen” om een plaatsje op het negatief geladen glas te bemachtigen.
De volgende stap in de kettingreactie in een zure test vloeistof vindt plaats in de harde glas laag. Onder neutrale omstandigheden zitten er positief geladen natriumionen door de harde glas laag heen op een willekeurige manier verspreidt. Wanneer er positief geladen waterstofionen uit de test vloeistof aan de zuurstofionen aan de buitenkant van het glas binden, dan veranderd dit. De positief geladen natrium ionen die in de buurt van de externe gel laag zitten worden als het ware weg gestoten, in de richting van de interne gel laag. Hierdoor bewegen ze dus wat dichter richting de negatief geladen zuurstof ionen die aan de kant van de interne gel laag zitten, zonder het glas te verlaten.
De laatste stap van de kettingreactie in een zure test vloeistof vindt plaats in de interne gel laag. Zoals eerder gezegd bewegen de positief geladen natriumionen die eerst in de buurt van de externe gel laag zaten richting de interne gel laag. Deze positief geladen natriumionen hebben een afstotend effect op de waterstofionen die aan de interne gel laag zijn gehecht. Eerder zeiden we al dat waterstofionen het “winnen” van andere positief geladen ionen, maar in dit geval is dat niet zo. Dit komt, omdat de natriumionen nergens anders naartoe kunnen, doordat er in een zure test vloeistof meer waterstofionen in de externe gel laag zitten dan in de interne gel laag.
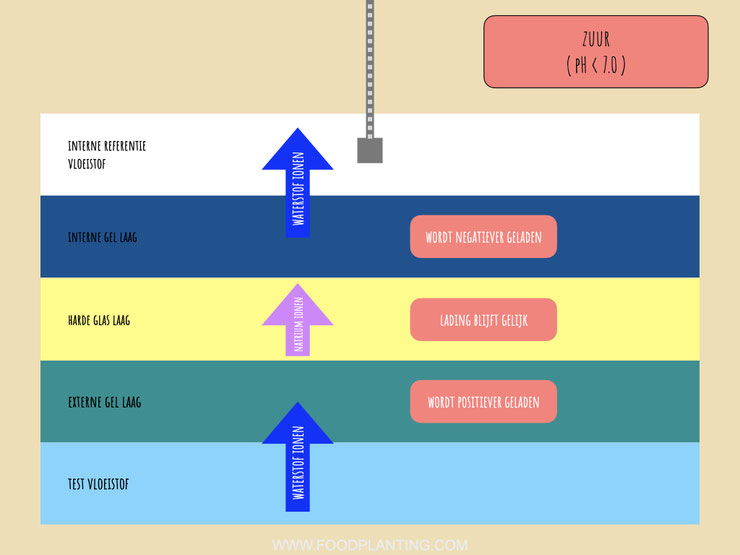
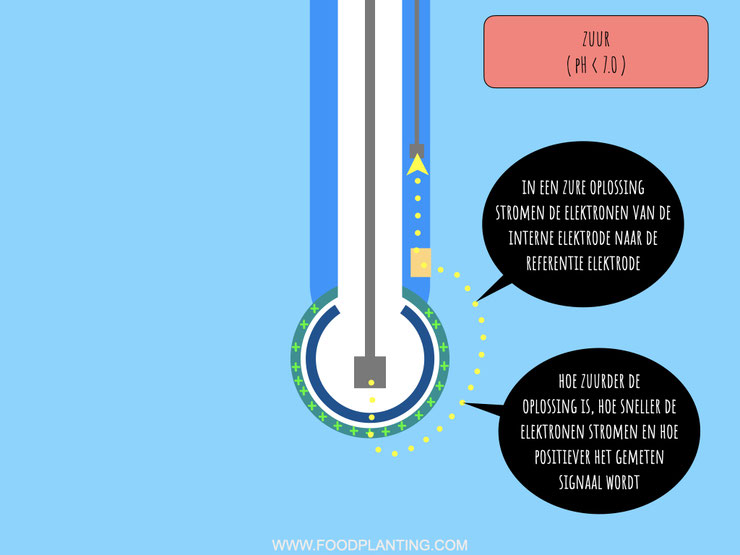
Wat er dus eigenlijk gebeurt in een zure oplossing is dat de externe gel laag van het pH gevoelige glas positiever geladen wordt, doordat er veel positief geladen waterstofionen aan de externe gel laag kleven. De interne gel laag wordt juist negatiever, doordat er hier minder positief geladen ionen aan kleven. Het chemische gradiënt loop in een zure vloeistof daarom van de externe gel laag, de hoge kant van het gradiënt, naar de interne gel laag, de lage kant van het gradiënt.
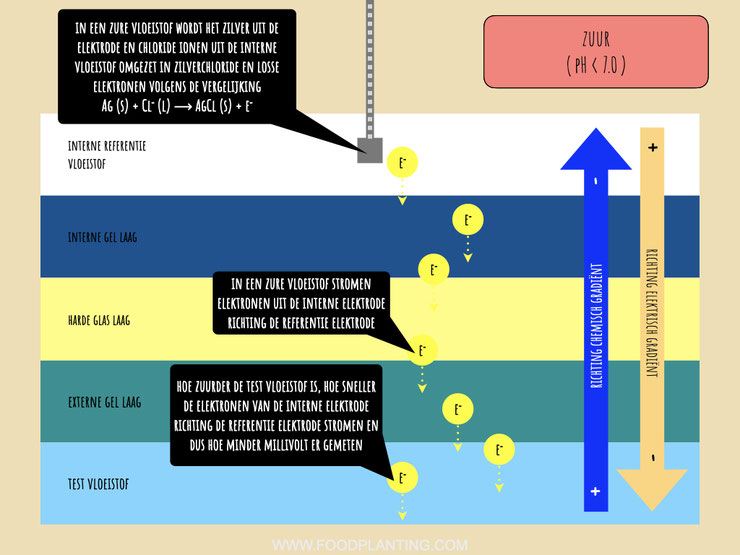
Het elektrische gradiënt loopt altijd in de tegengestelde richting van het chemische gradiënt. Dit betekent dat in een zure vloeistof elektrische energie van de binnenkant van de glaselektrode naar de buitenkant van de glaselektrode wordt getrokken. Door deze aantrekkingskracht vindt er een redox reactie plaats in de interne elektrode. De interne elektrode bestaat voor een deel uit zilverdeeltjes. Deze zilverdeeltjes staan in contact staan met chloorionen die in de interne vloeistof zitten. Doordat elektrische energie uit de glaselektrode wordt getrokken, vindt er een reactie tussen de zilverdeeltjes en de chloorionen plaats. De zilverdeeltjes en de chloorionen vormen namelijk zilverchloride. Wanneer dit gebeurt, dan ontstaat er een elektron, ofwel een pakketje met energie. In een zure reactie produceert de interne elektrode elektronen en werkt daarom in dat geval zoals een anode in een galvanische cel.
De elektronen die ontstaan wanneer er zilverchloride wordt gevormd stromen van de interne elektrode door het glas van de pH sensor richting de referentie elektrode. In de referentie elektrode vindt de omgekeerde redoxreactie plaats. Deze elektrode bestaat namelijk net als de interne elektrode voor een deel uit zilver en voor een deel uit zilverchloride, en maakt ook contact met een vloeistof waarin chloorionen zitten. Als de elektronen eenmaal bij de referentie elektrode aan komen, dan neemt het zilverchloride van de elektrode de elektronen op. Hierdoor wordt het zilverchloride weer ontbonden in zilverdeeltjes en negatief geladen chloorionen. In een zure oplossing werkt de referentie elektrode dus zoals een kathode in een galvanische cel.
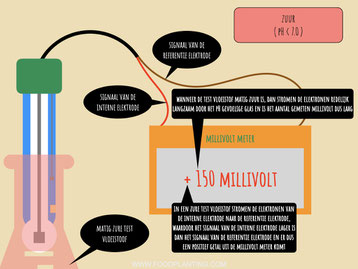
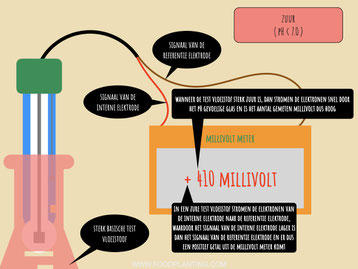
In een zure oplossing stromen de elektronen van de interne elektrode richting de referentie elektrode. Hierdoor ontstaat een positieve spanning, die de data-logger of de microcontroller als een positief millivolt signaal registreert. Hoe groot dit signaal is, hangt er vanaf hoe snel de elektronen van de interne elektrode richting de referentie elektrode stromen. De snelheid wordt weer bepaald door hoe groot verschil is tussen het aantal waterstofionen in de interne vloeistof en de testvloeistof. Hoe zuurder de test vloeistof is, hoe sneller de redox reacties plaatsvinden en hoe sneller de elektronen gaan stromen.
DE PH SENSOR IN EEN basische TEST VLOEISTOF
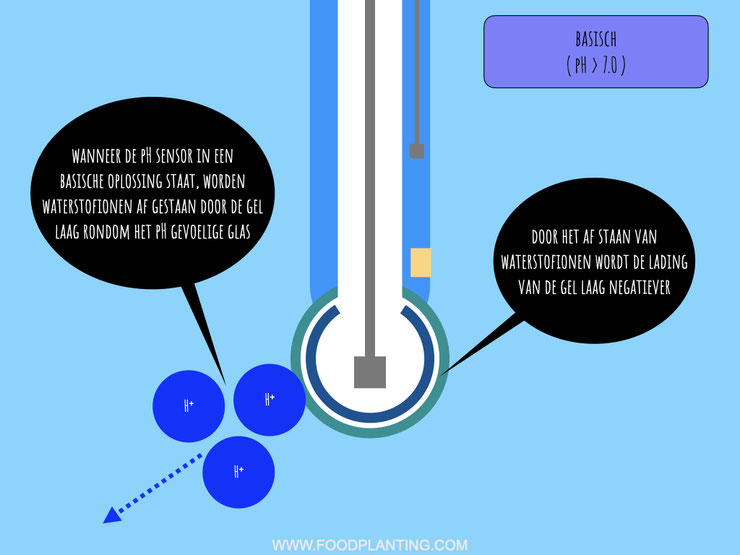
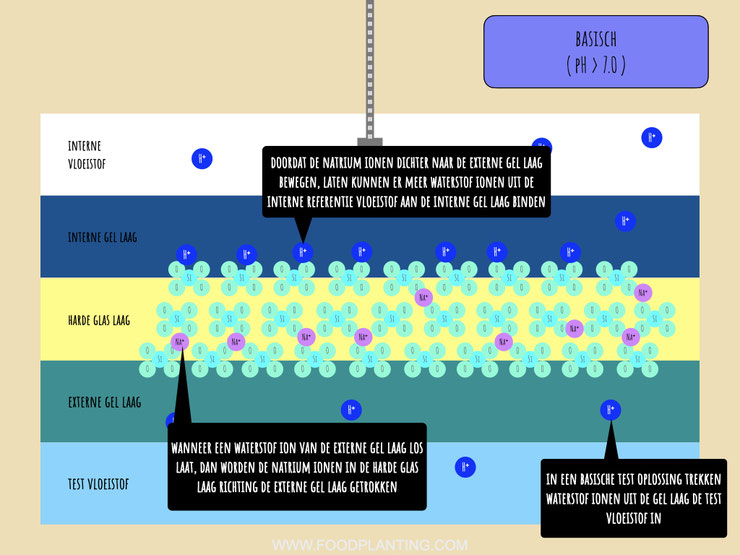
In een basische test vloeistof gebeurt vrijwel het tegenovergestelde met de pH-sensor als in de zure test vloeistof. Ook nu begint de reactie in de externe gel laag van het glazen uiteinde van de pH-sensor. Wanneer het glas van de pH-sensor in contact komt met een basische test vloeistof, dan zitten er meer positief geladen ionen in de externe gel laag dan in de test vloeistof. Zoals meestal het geval is bij chemische processen, stromen een aantal van de positief geladen ionen die in de externe gel laag zitten richting de test vloeistof om een chemisch evenwicht te bereiken. Ondanks dat dit een groot effect heeft op de werking van de pH sensor, stromen er zo weinig ionen in de test vloeistof dat dit geen effect heeft op de eigenschappen van de test vloeistof als een geheel.
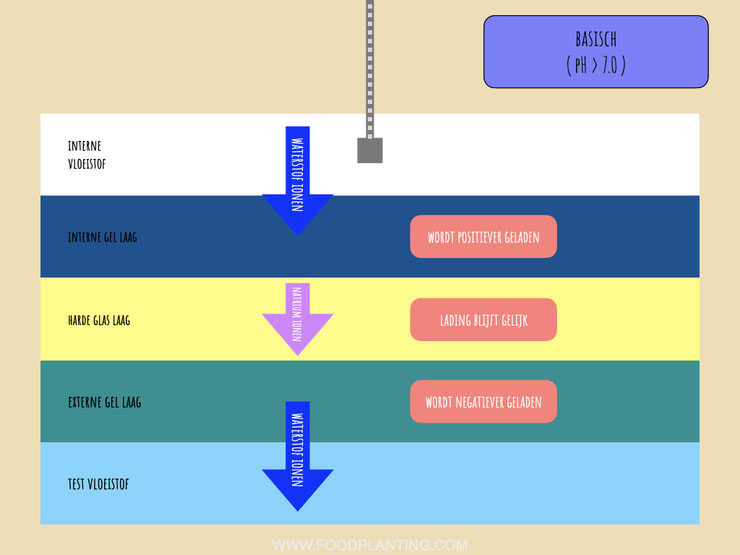
Doordat er positief geladen ionen uit de externe gel laag stromen, wordt de externe gel laag iets negatiever geladen dan eerder. Als een reactie hierop bewegen de positief geladen natriumionen ,die zich in de harde glas laag bevinden, richting de externe glas laag, zonder de harde glas laag te verlaten. De positief geladen natriumionen worden namelijk aangetrokken door de negatieve lading van de externe gel laag.
Doordat de natriumionen meer aan de kant van de externe gel laag gaan zitten, worden de waterstofionen uit de interne vloeistof aangetrokken richting de interne gel laag. Door het hechten van positief geladen waterstofionen aan de interne gel laag wordt deze dus wat positiever geladen. Het chemische gradiënt loopt in het geval van een basische vloeistof dan ook van de interne gel laag, waar de meeste waterstofionen zitten, richting de test vloeistof, waar de minste waterstofionen zitten.
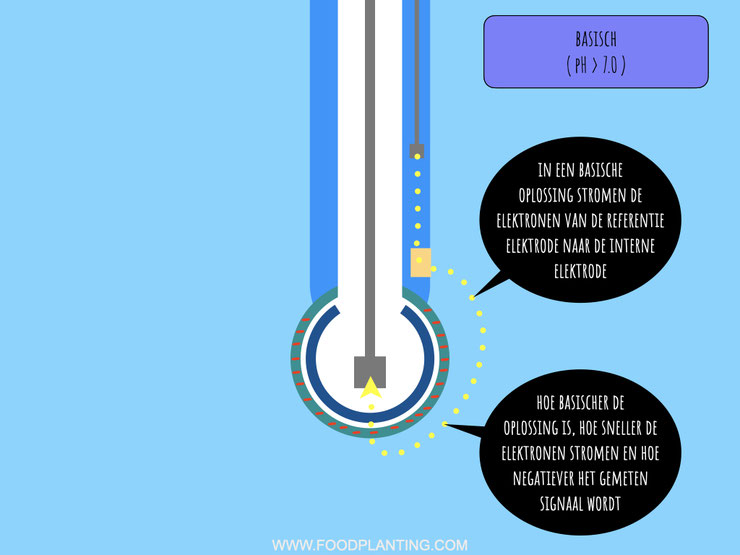
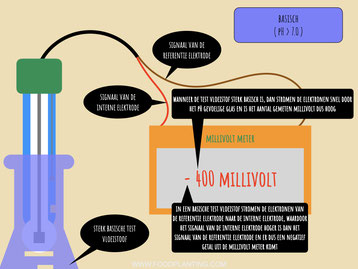
Aangezien het elektrische gradiënt nu van de buitenkant van de glaselektrode richting de binnenkant van de glaselektrode loopt, vindt er ook een andere reactie plaats in de interne elektrode. In een basische vloeistof stromen elektronen van de referentie elektrode richting de interne elektrode. In de referentie elektrode worden er nu zilverdeeltjes en chloorionen omgezet in zilverchloride en losse elektronen, terwijl in de interne elektrode nu juist elektronen worden opgenomen om zilverchloride om te zetten in zilverdeeltjes en chloorionen. In een basische vloeistof werkt de interne elektrode dus als een kathode en de referentie elektrode als een anode.

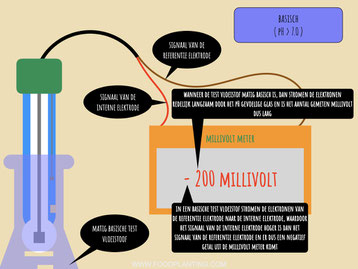
De referentie elektrode wordt meestal aangesloten op de aarde aansluiting, terwijl de interne elektrode wordt aangesloten op de aansluiting voor het signaal. Hierdoor wordt bij de meeste data-loggers en microcontrollers het signaal van de interne elektrode van het signaal van de referentie elektrode af getrokken. In een zure oplossing stromen de elektronen van de interne elektrode weg, waardoor het signaal van de interne elektrode lager is en er dus een positief aantal millivolt wordt gemeten. In een basische oplossing stromen de elektronen de andere kant op, waardoor het signaal van de interne elektrode hoger is dan het signaal van de referentie elektrode, en er dus een negatief aantal volt wordt gemeten.
Het aantal gemeten millivolt bevat dus eigenlijk twee stukjes informatie. Allereerst verteld de grootte van het cijfer dat er op de pH-meter staat of uit de microcontroller komt hoe snel de elektronen van de ene naar de andere elektrode stromen. Hoe groter dit cijfer is, hoe sterker de oplossing is. Als er bij vloeistof A 200 millivolt wordt gemeten en bij vloeistof B 400 millivolt wordt gemeten, dan weet je dus dat vloeistof B sterker is dan vloeistof A. Daarnaast verteld het plus of min teken voor het cijfer of het om een zure of basische oplossing gaat. Staat er een plus, dan is de oplossing zuur, en staat er een min, dan is de oplossing basisch, tenzij de pH sensor anders wordt aangesloten dan de meeste gangbare pH sensoren.
VRAGEN EN OPMERKINGEN
We proberen de serie DE PROGRAMMEERBARE PLANTENKAS zo toegankelijk mogelijk te maken voor iedereen. Toch zijn sommige concepten best wel ingewikkeld, omdat er kennis van heel veel verschillende domeinen, zoals natuurkunde, elektrotechniek en computerwetenschappen, samen komen. Het kan daarom best zijn dat we iets niet goed uitgelegd hebben. Mocht er iets niet duidelijk zijn of iets niet zo werken zoals we het in deze tutorial uitgelegd hebben, stuur dan gerust een berichtje via de Disqus op deze pagina. Je kunt de Disqus vinden door naar beneden te scrollen, tot onder de bronvermelding en de advertenties.
Bronnen en verder lezen
- Abe, Y., & Maeda, M. (2000). Origin of pH‐Glass Electrode Potentials and Development of pNa‐Responsive Glasses. Journal of The Electrochemical Society, 147(2), 787.
- Amemiya, S. (2007). Potentiometric ion-selective electrodes. In Handbook of electrochemistry (pp. 261-294). Elsevier.
- Belyustin, A. A., Pronkin, A. A., Ivanovskaya, I. S., Derii, V. V., Murin, I. V., & Sokolov, I. A. (2000). A lithium-selective glass electrode. Journal of Analytical Chemistry, 55(11), 1040-1044.
- Belyustin, A. A. (2011). The centenary of glass electrode: from Max Cremer to FGK Baucke. Journal of Solid State Electrochemistry, 15(1), 47-65.
- Blake, A. C., Light, T. S., Hoyle, D. L., Myron, T. J., & Mcmillan, G. K. (2018). pH Measurement. In Analytical Instrumentation (pp. 312-329). Routledge.
- Boyer, R. F. (2012). Biochemistry laboratory: modern theory and techniques, 2nd Editio.
- Brupbacher, R. H. (1968). Analytical methods and procedures used in the soil testing laboratory.
- Chaudhary, S. R., & Bhadane, S. P. B. P. K. (2015). Development of Microcontroller Based System for the Diagnosis of pH Electrode. Development, 4(8).
- Cheng, K. L. (1989). pH glass electrode and its mechanism.
- Cheng, K. L., & Zhu, D. M. (2005). On calibration of pH meters. Sensors, 5(4), 209-219.
- Cummings, W. G., Torrance, K., & Verhappen, I. (2003). Chemical analysis: Electrochemical techniques. In Instrumentation Reference Book (pp. 343-381). Butterworth-Heinemann.
- Doremus, R. H. (1970). Potentials in Ion-specific Electrodes. Croatica Chemica Acta, 42(2), 111-116.
- Durst, R. A. (1967). Mechanism of the glass electrode response. Journal of Chemical Education, 44(3), 175.
- Eisenman, G. (1962). Cation selective glass electrodes and their mode of operation. Biophysical journal, 2(2 Pt 2), 259.
- Fischer, R. B. (1974). Ion-selective electrodes.
- Głąb, S., Maj-Żurawska, M., & Hulanicki, A. (2013). Ion-Selective Electrodes | Glass Electrodes. Reference Module in Chemistry, Molecular Sciences and Chemical Engineering. Published. https://doi.org/10.1016/b978-0-12-409547-2.00266-3
- Graham, D. J., Jaselskis, B., & Moore, C. E. (2013). Development of the glass electrode and the pH response. Journal of Chemical Education, 90(3), 345-351.
- HACH. (2018, januari). What is pH and how is it measured? (DOC182.53.90628).
- Haugaard, G. (1941). The Mechanism of the Glass Electrode. The Journal of Physical Chemistry, 45(1), 148-157.
- Karastogianni, S., Girousi, S., & Sotiropoulos, S. (2016). pH: principles and measurement. The Encyclopedia of Food and Health, 4, 333-338.
- Kerridge, P. T. (1925). The use of the glass electrode in biochemistry. Biochemical Journal, 19(4), 611.
- Khan, M. I., Mukherjee, K., Shoukat, R., & Dong, H. (2017). A review on pH sensitive materials for sensors and detection methods. Microsystem Technologies, 23(10), 4391-4404.
- Mabbott, G. A. (2020). Electroanalytical Chemistry: Principles, Best Practices, and Case Studies (Chemical Analysis: A Series of Monographs on Analytical Chemistry and Its Applications) (1ste ed.). Wiley.
- Mcmillan, G. (2009). The essentials of pH measurement design, installation, maintenance, and improvement.
- Mikhelson, K. N. (2013). Ion-selective electrodes (Vol. 81). Berlin, Germany:: Springer.
- Oláh, K. (1960). On the theory of the alkaline error of the glass electrode. Periodica Polytechnica Chemical Engineering, 4(2), 141-156.
- Oliver, R. T., & Light, T. S. (2018). Ion-selective Electrodes. In Analytical Instrumentation (pp. 186-196). Routledge.
- Perley, G. A. (1949). Glasses for measurement of pH. Analytical Chemistry, 21(3), 394-401.
- Riddle, P. (2011). pH meters and their electrodes: calibration, maintenance and use. Biomedical Scientist, 55(3), 168.
- Saaid, M. F., Sanuddin, A., Ali, M., & Yassin, M. S. A. I. M. (2015, April). Automated pH controller system for hydroponic cultivation. In 2015 IEEE Symposium on Computer Applications & Industrial Electronics (ISCAIE) (pp. 186-190). IEEE.
- Scholz, F. (2011). From the Leiden jar to the discovery of the glass electrode by Max Cremer. Journal of Solid State Electrochemistry, 15(1), 5-14.
- Webster, J. G. (Ed.). (1999). The Measurement, Instrumentation, and Sensors: Handbook. Springer Science & Business Media.
- Westerman, R. L. (1991). Soil testing and plant analysis.
- Vanysek, P. (2004). The Chalkboard: The Glass pH Electrode. The Electrochemical Society Interface, 13(2), 19.
- Vonau, W., & Guth, U. (2006). pH monitoring: a review. Journal of Solid State Electrochemistry, 10(9), 746-752.