
De voornaamste reden om een kas te nemen is om planten te kunnen kweken waar het buiten, of zelfs in huis, te koud voor is. Hierdoor kun je met behulp van een kas in Nederland en België bijvoorbeeld zelf meloenen kweken. Zonder kas is het de meeste jaren aan het einde van de zomer en het begin van de herfst te koud om warmte minnende planten, zoals meloenen, volledig te laten rijpen. In een kas blijft het vaak tot ver in de herfst warm genoeg om de meloenen wel te laten rijpen. Dit komt, omdat er in een kas het broeikaseffect plaats vindt.
Het broeikaseffect ontstaat door de combinatie van de eigenschappen van de lichtdeeltjes in zonlicht en de isolerende werking van het glas of het kunststof waar een kas van is gemaakt. Het broeikaseffect wordt veroorzaakt door de eigenschappen van de lichtdeeltjes die zich in de stralen van de zon bevinden. In dit artikel vertellen we stap-voor-stap hoe lichtdeeltjes, in samenwerking met het glas (of kunststof) waar de kas van is gemaakt, de kas opwarmen.
De transmissie van lichtdeeltjes door het glas van de kas
Wanneer een straal zonlicht op het glas van een kas terecht komt, dan komen de lichtdeeltjes, die ook wel fotonen worden genoemd, die in de zonnestraal zitten in contact met een oppervlak. Op het eerste oog lijkt glas (of transparant kunststof) al het licht door te laten. Dit komt, omdat onze ogen alleen gevoelig zijn voor lichtdeeltjes die in het zichtbaar spectrum vallen. Andere lichtdeeltjes, zoals UV-lichtdeeltjes en infrarood lichtdeeltjes, kunnen onze ogen niet waarnemen. Met speciale onderzoeksapparatuur, is het mogelijk om te zien dat glas maar een deel van de lichtdeeltjes uit een zonnestraal doorlaat en een ander deel van de lichtdeeltjes terug de lucht in weerkaatst.

Het glas van een kas laat vooral het zichtbare licht uit zonlicht door, en weerkaatst een groot deel van het UV-licht en infrarood licht. Hoeveel UV-licht en infrarood licht er precies door het glas van een kas wordt weerkaatst, hangt erg af van het soort glas dat gebruikt wordt. Sommige glassoorten laten bijvoorbeeld maar 20% van het UV-licht door, terwijl andere glassoorten 80% van het UV-licht doorlaten. Hetzelfde geldt voor infrarood licht, er zijn glassoorten die minder dan 5% infrarood licht doorlaten, terwijl andere glassoorten 50% van het infrarood licht doorlaten. Of een lichtdeeltje met een bepaalde golflengte de kas binnenkomt, hangt dus erg af van de eigenschappen van het glas dat gebruikt is om de kas van te maken.

De interactie tussen lichtdeeltjes in de kas en oppervlakten
Als lichtdeeltjes eenmaal door het glas van de kas zijn gekomen, dan blijven ze verder bewegen tot ze weer een oppervlakte tegen komen. Oppervlaktes, bijvoorbeeld de rode huid van een tomaat of de buitenkant van een zwarte baksteen, zijn opgebouwd uit moleculen, die weer opgebouwd zijn uit atomen, die weer opgebouwd zijn uit een atoomkern met daaromheen een wolk van elektronen. Lichtdeeltjes zijn zo klein dat ze met de elektronen die om een atoomkern zweven kunnen reageren.
Welke reactie er precies plaatsvindt tussen een lichtdeeltje en de elektronen die rond een atoomkern zweven, hangt af van de golflengte van het lichtdeeltje en de eigenschappen van het atoom. De golflengte van een lichtdeeltje bepaald hoeveel energie een lichtdeeltje met zich mee draagt. Hoe korter de golflengte is, hoe meer energie een lichtdeeltje bevat. Een lichtdeeltje kun je daarom ook wel voorstellen als een pakketje met energie. Lichtdeeltjes kunnen in drie categorieën worden opgedeeld, afhankelijk van hoeveel energie ze hebben.

Lichtdeeltjes met een schadelijke hoeveelheid energie
Een lichtdeeltje met een korte golflengte bevatten heel veel energie. Voorbeelden hiervan zijn röntgenstralen en hele sterke UVC-stralen. Doordat deze lichtdeeltjes zo veel energie met zich mee brengen, kunnen ze, als ze in contact komen met een elektron die rondom een atoomkern zweeft, een elektron uit een atoom schieten. Wanneer dit vaak op dezelfde plek gebeurt treden er in veel gevallen beschadigen op aan het oppervlakte van een object, of van de cellen van een plant of een dier. Lichtdeeltjes met veel energie zorgen er bijvoorbeeld voor dat de kleur van plastic vervaagd wanneer het lang in de zon staat en dat de DNA moleculen in onze huid beschadigen als we vaak zonder zonnebrandcrème op in de volle zon zitten.
Gelukkig werkt het glas van de kas een beetje hetzelfde als zonnebrand crème: Het glas weerkaatst lichtdeeltjes met zoveel energie dat ze elektronen bij een atoom weg kunnen schieten terug de lucht in. In de meeste kassen zul je daarom geen UVC-licht en weinig UVB-licht vinden.
Zwakkere UV-lichtdeeltjes en zichtbare lichtdeeltjes
Het glas van een kas laat wel UV-lichtdeeltjes met minder energie en zichtbaar licht door. Deze lichtdeeltjes hebben dan ook de grootste invloed op het klimaat in de kas. Dit komt, omdat deze lichtdeeltjes een klein effect hebben op de elektronen van de atomen waaruit de dingen die zich in de kas bevinden zijn opgebouwd. De interactie tussen deze lichtdeeltjes en de elektronen is enorm complex, en nog lang niet helemaal begrepen door wetenschappers. Daarom proberen we deze interactie in kleine stapjes en zo simpel mogelijk uit te leggen, zodat je toch een idee hebt van hoe het broeikaseffect nu precies toestand komt.
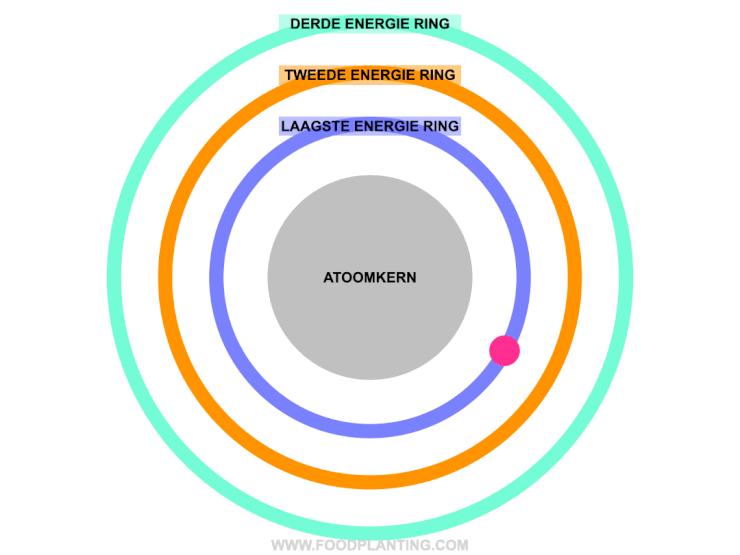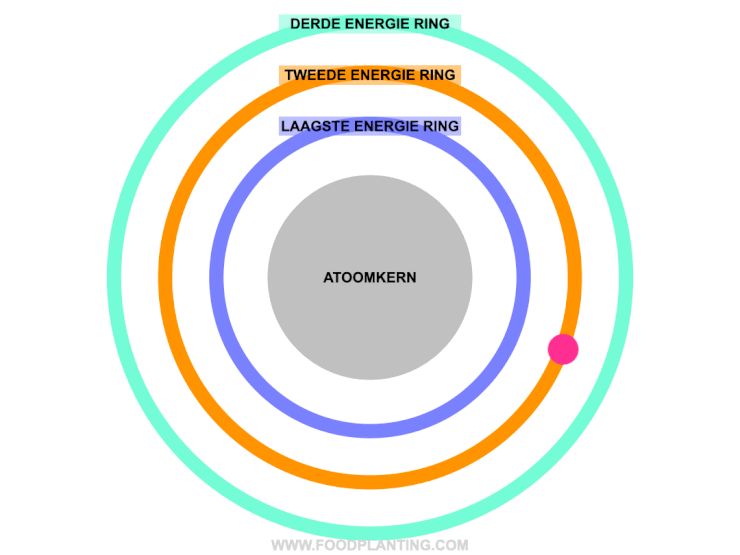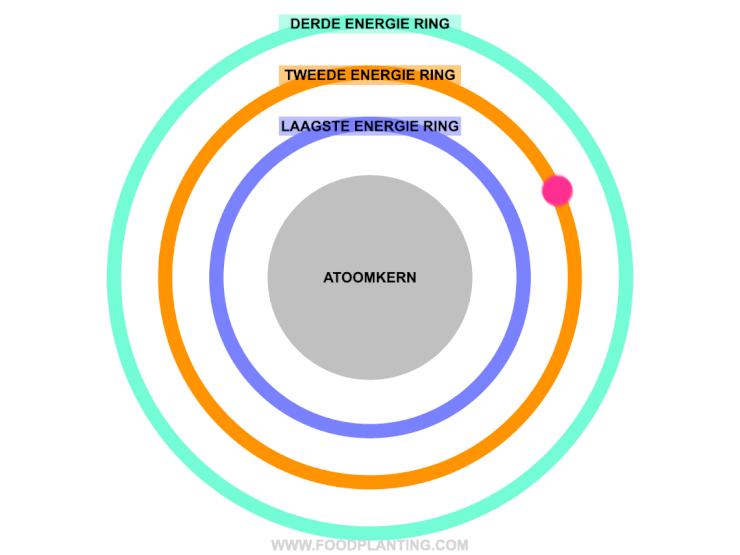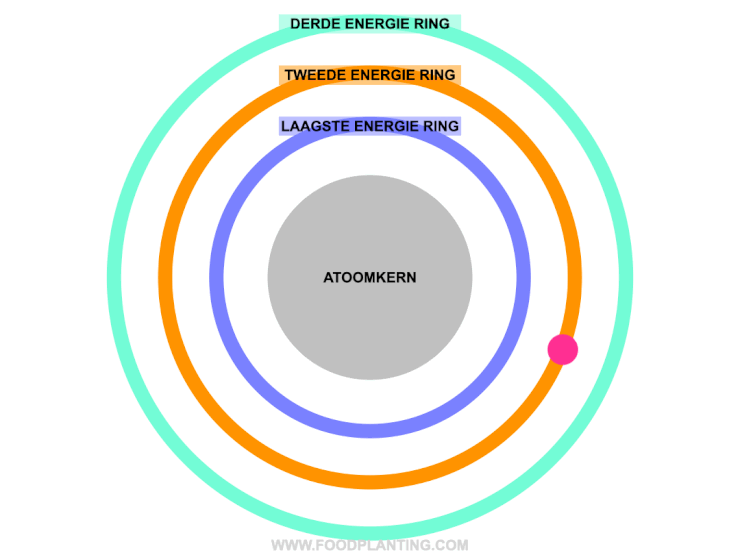
Om te begrijpen wat het effect is van een lichtdeeltje op een atoom, stellen we een atoom voor als een voetbalstadion. Het speelveld is de atoomkern, die altijd hetzelfde blijft. Rondom de atoomkern bevinden zich verschillende ringen, waar de elektronen van het atoom in verblijven. Zo’n ring wordt ook wel een elektronenschil genoemd. Elke ring bevat elektronen met een specifieke hoeveelheid energie. De binnenste ring, die het dichtste bij de atoomkern ligt, bevat de elektronen met de minste energie. Hoe verder een ring van de atoomkern af ligt, hoe meer energie de elektronen hebben die zich in die ring bevinden.
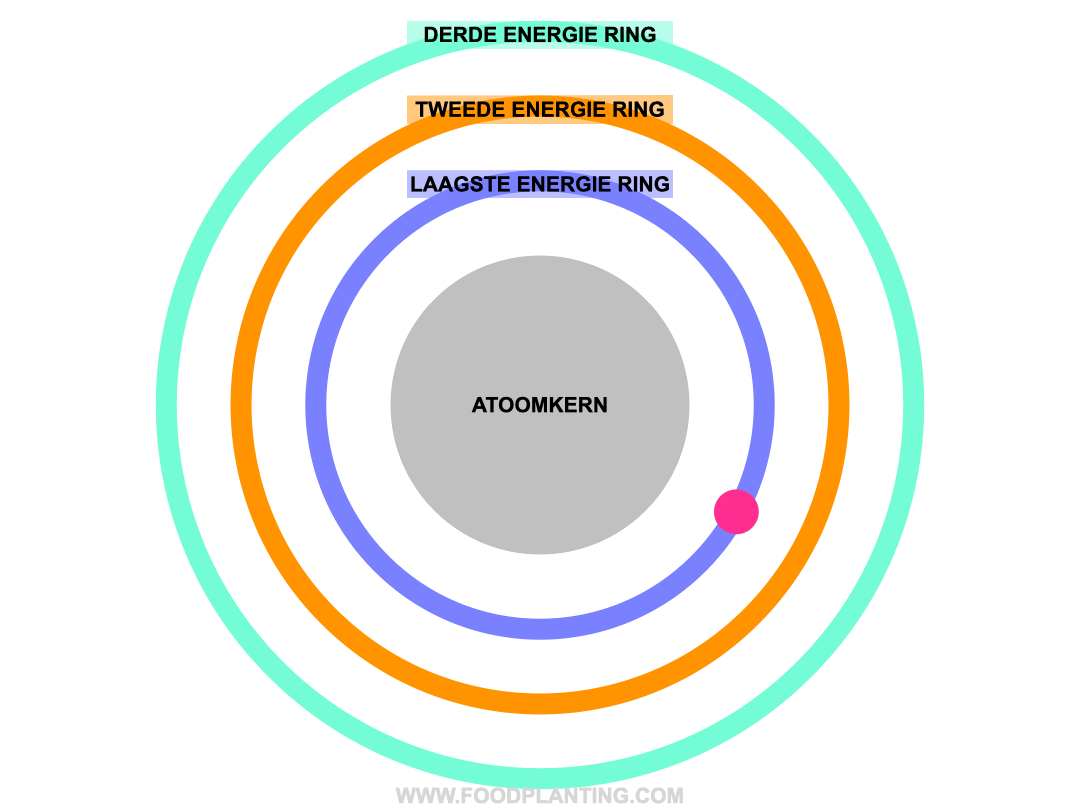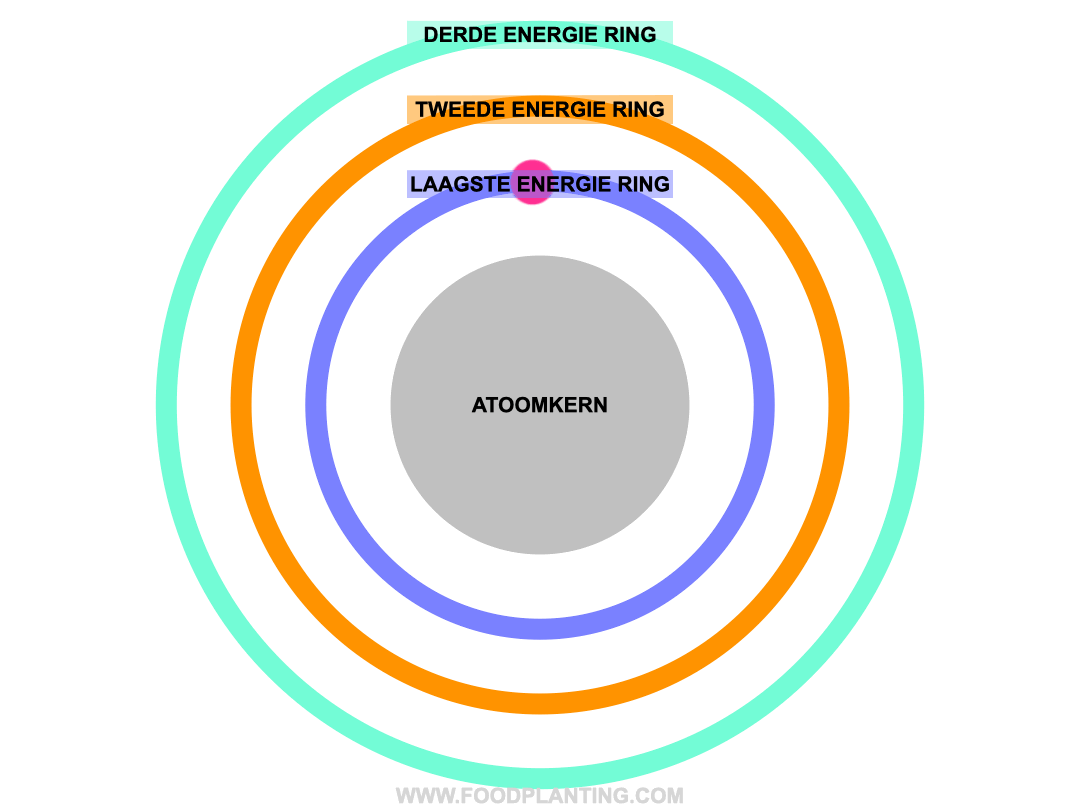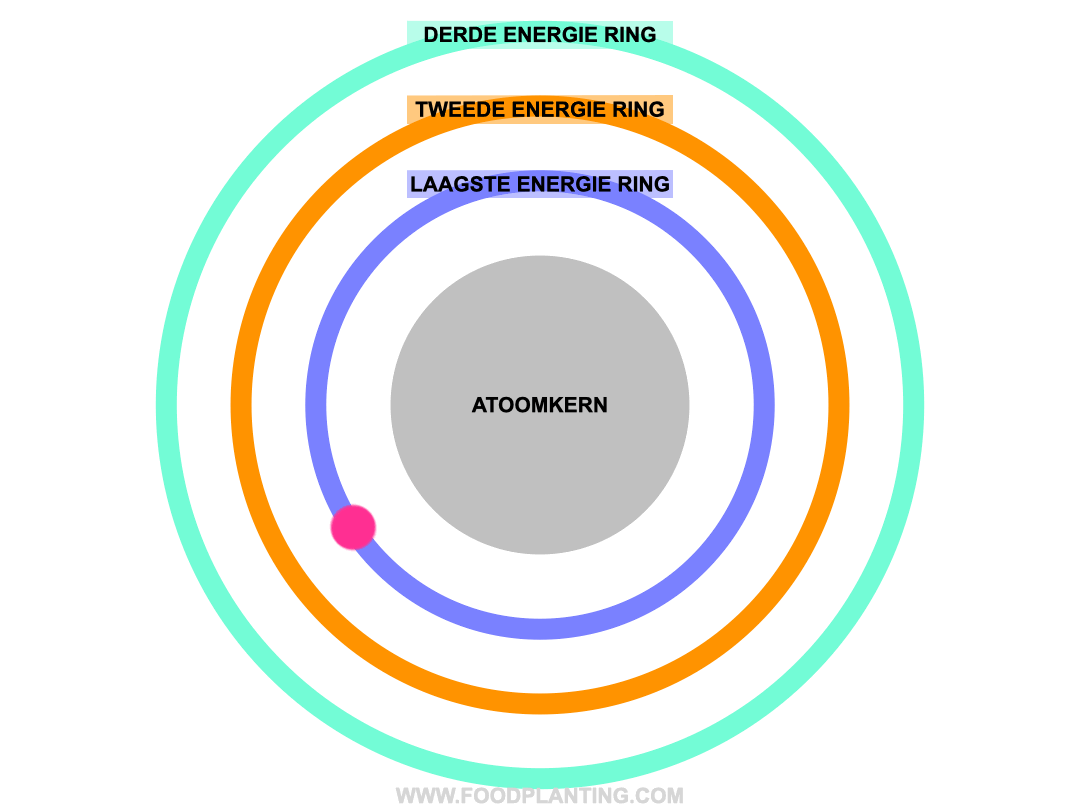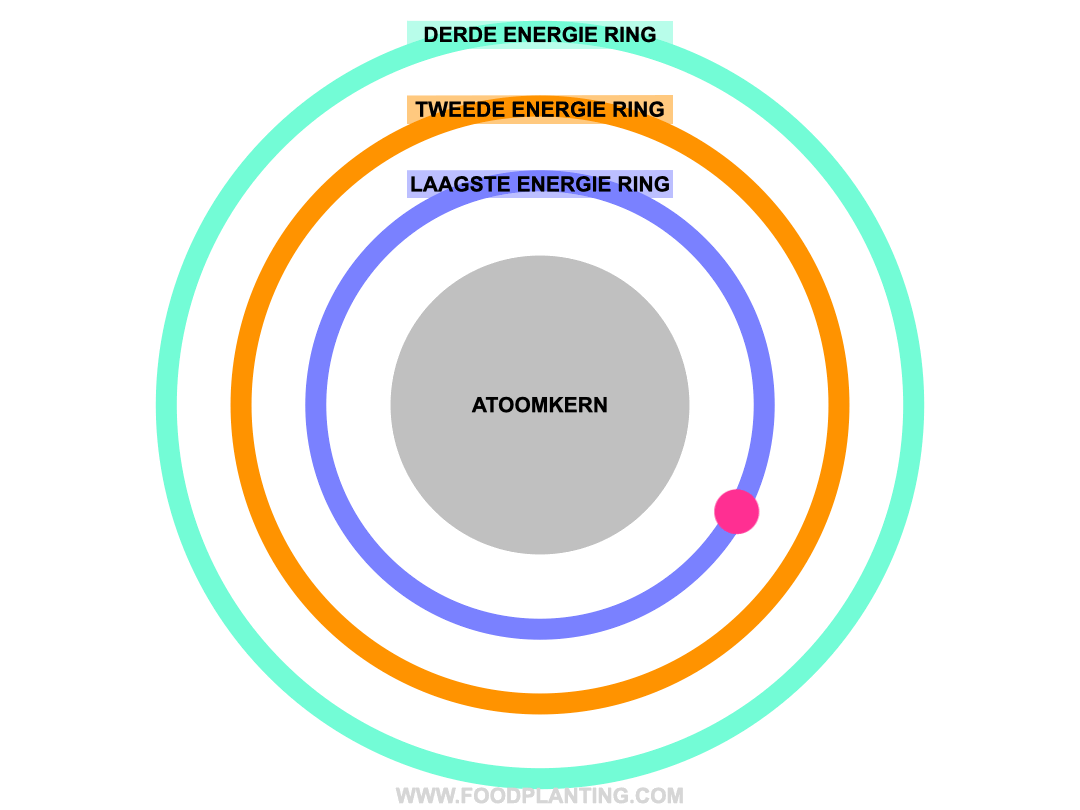
Als er helemaal geen licht is, en we alle andere invloeden op een atoom even buiten beschouwing houden, dan bewegen de elektronen van een atoom zich gezellig rond in hun eigen energiering. Zolang er niets met de atoom gebeurd, blijft de hoeveelheid energie die een elektron bevat hetzelfde, en kan een elektron dus niet spontaan naar een andere energiering verhuizen.
Het reflecteren of absorberen van de lichtdeeltjes
Om een elektron naar een hogere energiering te laten verhuizen, moet het elektron precies genoeg energie opnemen. Een elektron kan een lichtdeeltje, ofwel een pakketje met energie, absorberen als het lichtdeeltje precies genoeg energie bevat om naar een hogere energiering in het atoom te verhuizen. Wanneer dit gebeurd, dan wordt er ook wel gezegd dat het elektron aangeslagen is. Bevat het lichtdeeltje te veel of te weinig energie om genoeg energie te bevatten om naar een hogere energiering te gaan, dan wordt het lichtdeeltje afgestoten. Dit wordt ook wel reflectie genoemd.
Om het stukje hierboven wat begrijpbaarder te maken, gaan we weer even terug naar het beeld van het voetbalstadion. In het voetbalstadion kan een elektron alleen naar een hogere ring verhuizen als hij precies genoeg geld bij zich heeft om de volgende ring te kunnen betalen. Stel dat het elektron nu in een ring zit die € 5,- kost voor een kaartje. Het elektron mag zelf geen geld op zak hebben van het stadion, maar af en toe vallen er pakketjes met geld (de lichtdeeltjes) uit de lucht. Het geld dat in deze pakjes zit, mag het elektron alleen gebruiken als het precies genoeg is om het verschil tussen een kaartje van zijn eigen ring tot de volgend ring te overbruggen. Stel dat de volgende ring bijvoorbeeld € 7,- kost, dan kan het elektron alleen een ring omhoog verhuizen als hij een geld pakketje tegenkomt dat precies € 2,- bevat (het absorberen van een lichtdeeltje). Krijgt het elektron bijvoorbeeld een pakketje van € 3,-, en er is geen ring met een waarde van € 8,- in het atoom, dat wordt het geld pakketje weer terug gestuurd (het reflecteren van het lichtdeeltje).
In de praktijk zien we dagelijks het effect van het absorberen en weerkaatsen van lichtdeeltjes die een golflengte hebben die in het zichtbare licht vallen, met een golflengte tussen de 400 en 700 nanometer. Wanneer een oppervlakte rood is, bijvoorbeeld de huid van een rijpe tomaat, dan worden vrijwel alle lichtdeeltjes, behalve de rode lichtdeeltjes, door de elektronen in de huid van de tomaat geabsorbeerd. De rode lichtdeeltjes worden ongebruikt terug de ruimte in weerkaatst, waardoor ze door de lichtgevoelige cellen in onze ogen opgevangen kunnen worden, en wij dus rode tomaten zien.

Wat een oppervlakte doet met lichtdeeltjes die een golflengte hebben die buiten het visueel spectrum valt, is met het blote oog moeilijk te zeggen. Hiervoor moeten speciale metingen worden gedaan. Uit metingen blijkt bijvoorbeeld dat onze huid ongeveer 12% van het UVA licht, met een golflengte tussen de 315 en 400 nanometer, reflecteert. UVB licht, met veel meer energie per lichtdeeltje en dus een kortere golflengte van 280 tot 315 nanometer, wordt maar voor ongeveer 2,5% gereflecteerd.
Het effect van de geabsorbeerde lichtdeeltjes
Wanneer een lichtdeeltje eenmaal door een elektron geabsorbeerd is, en het elektron naar een hogere energiering is verhuisd, dan kan hij maar kort van zijn upgrade genieten. Ongeveer 0.00000000001 seconden nadat een elektron een lichtdeeltje heeft geabsorbeerd, verliest hij de energie die hij heeft opgenomen alweer, en moet hij terug naar zijn oorspronkelijke energiering verhuizen. Wanneer het elektron terug naar zijn oorspronkelijke energiering verhuisd, dan moet de energie die hij van het lichtdeeltje had gekregen weer ergens heen. Volgens de wetten van de natuurkunde kan energie namelijk niet “verdwijnen”. Voor elke ring die het elektron naar buiten is verhuisd, stuurt het elektron daarom één lichtdeeltje, ofwel een pakketje energie, het atoom uit. Dit wordt ook wel de emissie van een lichtdeeltje genoemd.

De energie die een nieuw lichtdeeltje bevat, en dus ook de golflengte die dit lichtdeeltje heeft, hangt af van het verschil in energie tussen de twee ringen waar het elektron tussen is verplaatst. Zo heeft de binnenste ring van een waterstofatoom een energiewaarde van -13,6 elektronvolt. De tweede energiering van een waterstofatoom heeft een energiewaarde van -3,4 elektronvolt. Als een elektron dus van de tweede ring terug naar de binnenste ring verhuisd, dan verliest het elektron 10,2 elektronvolt aan energie. Het lichtdeeltje dat hierdoor ontstaat heeft een golflengte van ongeveer 121 nanometer. Dit zou dan een UVC-lichtdeeltje zijn.
Wanneer een elektron een lichtdeeltje absorbeert om één energiering omhoog te verhuizen, dan heeft het nieuwe lichtdeeltje dat ontstaat bij het terug verhuizen van het elektron dezelfde hoeveelheid energie en dus ook dezelfde golflengte als het geabsorbeerde lichtdeeltje. Als een elektron een lichtdeeltje absorbeert dat zoveel energie bevat dat het elektron meerdere energieringen omhoog kan verhuizen, dan zijn de lichtdeeltjes die ontstaan bij het terug verhuizen van een andere golflengte dan het geabsorbeerde lichtdeeltje. Alle nieuwe lichtdeeltjes opgeteld hebben wel weer dezelfde hoeveelheid energie als het geabsorbeerde lichtdeeltje.

De nieuwe lichtdeeltjes die ontstaan wanneer een elektron meerdere energieringen terug moet verhuizen, hebben vaak een relatief lage golflengte. De golflengte van de meeste van deze nieuwe lichtdeeltjes is meestal zo laag dat ze niet meer met het blote oog te zien zijn. Ze vallen dan namelijk in de categorie van de infrarood lichtdeeltjes.
Doordat het glas waar de kas van is gemaakt infrarood licht reflecteert, kunnen de infrarood lichtdeeltjes die door het absorberen en uitstoten van UV-licht en zichtbaar licht door objecten in de kas zijn ontstaan niet uit de kas ontsnappen. Zolang de zon schijnt komen er hierdoor steeds meer infrarood lichtdeeltjes in de kas. Hieronder vertellen we wat het effect van deze infrarood lichtdeeltjes is op de moleculen die zich in de kas bevinden.

Infrarood lichtdeeltjes
Zoals eerder gezegd, heeft het glas (of kunststof) waar een kas van is gemaakt een reflecterende werking op infrarood licht. Hierdoor komt er meestal 0 tot 50% van het infrarood licht van het zonlicht dat op de kas valt in de kas terecht. Daarnaast komt er infrarood licht in de kas terecht door het absorberen en uitstoten van lichtdeeltjes door de objecten die zich in de kas bevinden, zoals we hierboven besproken hebben. Zolang het licht is buiten, zullen er dus altijd infrarood lichtdeeltjes in de kas zitten die een golflengte hebben tussen de 700 en 100.000 nanometer.
Anders dan lichtdeeltjes met zeer veel energie, zoals röntgenstralen, UV-lichtdeeltjes en zichtbare lichtdeeltjes, hebben infrarood lichtdeeltjes geen direct effect op de elektronen in een atoom. In plaats daarvan hebben infrarood lichtdeeltjes een effect op de verbindingen tussen de verschillende atomen in een molecuul. De verbindingen tussen de atomen in een molecuul zijn niet statisch, zoals een satéprikker, maar beweeglijk, zoals een springveer. Doordat een molecuul altijd een minimale hoeveelheid energie met zich mee draagt trillen de verbindingen tussen de atomen in een molecuul altijd een beetje. Dit geldt zowel voor moleculen die een vaste stof vormen (bijvoorbeeld in een zandkorrel), die een vloeibare stof vormen (bijvoorbeeld water bij kamertemperatuur), en die een gas vormen (bijvoorbeeld koolstofdioxide in de lucht).

Wanneer er een infrarood lichtdeeltje op een molecuul valt, dan kan deze net als bij UV-lichtdeeltjes en zichtbare lichtdeeltjes gereflecteerd of geabsorbeerd worden. Of een infrarood lichtdeeltje geabsorbeerd of gereflecteerd wordt, hangt af van de samenstelling van het molecuul. Een molecuul dat uit een setje van twee atomen van dezelfde soort bestaat, zoals zuurstof (O₂) of stikstof (N₂) kan maar op één manier trillen, wat ook wel vibreren genoemd wordt. Deze moleculen kunnen daarom helemaal geen infrarood licht opnemen. Als een infrarood lichtdeeltje op zo’n molecuul terecht komt, dan wordt hij weg gekaatst, als een tennisbal die tegen een muur wordt gegooid.
Moleculen die uit meer dan twee atomen bestaan, zoals koolstofdioxide (CO₂), ozon (O₃) en water (H₂O), kunnen wel op verschillende manieren trillen. Deze moleculen kunnen daarom wel infrarood lichtdeeltjes absorberen. Elke manier waarop een specifieke molecuulsoort kan trillen, kan worden geactiveerd door een infrarood lichtdeeltje met een specifieke golflengte, en dus een specifieke hoeveelheid energie. Zo zal een mid-infrarood lichtdeeltje van 3.788 nanometer de verbindingen van een koolstofdioxide molecuul asymmetrisch laten trillen, en een ver-infrarood lichtdeeltje van 18.315 nanometer hetzelfde koolstofdioxide deeltje op een buigende manier laten trillen. Zoals we eerder hebben verteld, hebben lichtdeeltjes met een kortere golflengte meer energie in zich dan lichtdeeltjes met een langere golflengte. De soort trillingen die ontstaan door het absorberen van het mid-infrarood lichtdeeltje zijn dus energierijker dan de trillingen die ontstaan door het absorberen van het ver-infrarood lichtdeeltje.
Het effect van een geabsorbeerd infrarood lichtdeeltje is maar kort. Hierdoor zal een molecuul na een korte tijd op een energiekere manier getrild te hebben door het opnemen van een infrarood lichtdeeltje weer op zijn oude vertrouwde manier gaan trillen. Ook hier geldt weer dat energie niet zomaar kan “verdwijnen”. Wanneer een molecuul van een energiekere manier van trillen weer terug gaat naar zijn “normale” manier van trillen, zullen er daarom weer één of meer lichtdeeltjes uitgestoten worden.

Net als bij UV-lichtdeeltjes en zichtbare lichtdeeltjes, kan een geabsorbeerd infrarood lichtdeeltje voldoende energie bevatten om het molecuul één stand energieker te laten trillen, maar kan het ook voldoende energie bevatten om het molecuul meerdere standen energieker te laten trillen. Ook hierbij geldt dat er per stand dat het molecuul energieker is gegaan trillen er één lichtdeeltje wordt uitgestoten. Wanneer het molecuul één stand energieker is gaan trillen, dan zal het uitgestoten lichtdeeltje dezelfde golflengte, en dus dezelfde hoeveelheid energie, bevatten als het geabsorbeerde lichtdeeltje. Is het molecuul meerdere standen energieker gaan trillen, dan zal er per stand een lichtdeeltje worden uitgezonden dat minder energie heeft dan het geabsorbeerde lichtdeeltje. Alle lichtdeeltjes opgeteld die worden uitgestoten om terug naar de basisstand, ook wel grondtoestand genoemd, te gaan hebben wel weer evenveel energie als het geabsorbeerde lichtdeeltje.
Warmte door bewegende moleculen
Hierboven hebben we eerst besproken hoe het absorberen en daarna weer uitstoten van lichtdeeltjes gaat. Hierdoor weet je dat infrarood lichtdeeltjes op twee manieren in de kas kunnen komen: Er kunnen een aantal infrarood lichtdeeltjes die in zonlicht zitten via het glas (of kunststof) de kas binnenkomen. De hoeveelheid infrarood lichtdeeltjes die op deze manier de kas binnenkomt, hangt sterk af van de eigenschappen van het glas dat is gebruikt om de kas van te maken. Sommige soorten glas laten een grote hoeveelheid infrarood lichtdeeltjes door, terwijl andere soorten glas een barrière vormen waar geen infrarood deeltjes doorheen kunnen. Daarnaast komen er infrarood lichtdeeltjes in de kas door het absorberen van de energie in UV-lichtdeeltjes en zichtbare lichtdeeltjes door materialen in de kas. De geabsorbeerde energie wordt vervolgens uitgestoten in de vorm van lichtdeeltjes waarvan een deel een infrarood golflengte heeft. Zelfs als het glas van de kas helemaal geen infrarood licht doorlaat, zit er dus toch infrarood licht in de kas.
We hebben hierboven ook verteld dat de atomen binnen een molecuul altijd aan het bewegen zijn, en dat deze bewegingen energieker kunnen worden door het absorberen van infrarood licht. Wat we nog niet hebben verteld, is hoe dit er uiteindelijk toe leidt dat het overdag in de kas veel warmer is dan daarbuiten. Dat is namelijk de volgende stap in het verhaal van hoe het broeikaseffect werkt.
De temperatuur van een stof, bijvoorbeeld het water dat je gebruikt om te irrigeren, de stam van een boom of de lucht in de kas, wordt bepaald door de hoeveelheid energie die in de moleculen zitten waaruit datgene waarvan je de temperatuur meet is opgebouwd. De hoeveelheid energie die een molecuul mee draagt, bepaald hoeveel een molecuul beweegt en andersom bepaald de beweging van een molecuul hoeveel energie een molecuul bevat.
Eerder hebben we al verteld dat het absorberen van infrarood lichtdeeltjes een molecuul energieker laat vibreren. De hoeveelheid energie die een molecuul bevat in de vorm van trillingen, wordt ook vibrationele energie genoemd. Stel dat je de temperatuur van een enkel koolstofdioxide molecuul zou meten als deze een infrarood lichtdeeltje heeft geabsorbeerd, dan zou het molecuul dus een hogere temperatuur hebben dan voordat het lichtdeeltje geabsorbeerd was.
Een andere manier waarop een molecuul kan bewegen is door de ruimte. Dit kan een grote ruimte zijn, zoals alle buitenlucht op aarde, maar ook een kleine ruimte, zoals de binnenkant van een frisdrankblikje dat nog dicht is. De snelheid waarmee een molecuul door de ruimte beweegt, wordt bepaald door de hoeveelheid translationele energie die een molecuul bezig.
Als laatste kan een molecuul ook nog rotationele energie bevatten. Dit wordt bepaald door de mate waarin een molecuul om zijn eigen as draait. Voor het broeikaseffect is dit minder van belang, dus laten we deze vorm van energie verder buiten beschouwing.

Wanneer een botsing tussen moleculen plaatst vindt, kan een molecuul zijn overtollige vibrationele energie, die hij heeft gekregen door het absorberen van een infrarood lichtdeeltje, afstaan aan de molecuul waarmee hij bots. De overtollige vibrationele energie van de ene molecuul, wordt in de vorm van translationele energie opgenomen door de andere molecuul. Hierdoor gaat de molecuul die in eerste instantie minder energie bevatte dus sneller door de ruimte bewegen.

De tijd die tussen het absorberen en het weer uitstoten van een infrarood lichtdeeltje zit, is vrij lang, namelijk een paar milliseconden tot enkele duizenden milliseconden. Hierdoor is de kans groot dat een molecuul die energie geabsorbeerd heeft op een ander molecuul botst en zijn energie kan doorgeven. Dit andere molecuul kan elk ander molecuul zijn, en hoeft dus niet per se een molecuul te zijn dat infrarood licht opneemt. Zo kan een koolstofdioxide molecuul zijn geabsorbeerde energie afgeven aan een stikstofmolecuul (N₂) dat niet op infrarood licht reageert. Hierdoor wordt de energie uit infrarood lichtdeeltjes dus uiteindelijk over alle moleculen in de lucht van de kas en de objecten in de kas verspreidt. Doordat het glas van de kas voorkomt dat de opgewarmde, ofwel beweeglijkere, moleculen uit de kas kunnen ontsnappen, wordt het binnen in de kas na een tijdje warmer dan er buiten.
Vragen en opmerkingen
Het zelf kweken van groenten, fruit, kruiden en bloemen gaat meestal gemakkelijk, maar soms zit er ook wel eens wat tegen. Mocht je een vraag hebben over het kweken van planten, dan zullen wij deze zo goed mogelijk proberen te beantwoorden. Je kunt je vragen onderaan deze pagina stellen, via het Disqus formulier. Om naar het Disqus formulier te gaan, moet je nog iets verder naar beneden scrollen, tot voorbij de advertenties.
Bronnen en verder lezen
- Acrivos, J. & Levine, Ira N. (1988). Physical chemistry.
- Ahrens, C. D. (2011). Essentials of meteorology: an invitation to the atmosphere. Nelson Education.
- Archer, D. (2011). Global warming: understanding the forecast. John Wiley & Sons.
- Atkins, P. W., & De Paula, J. (1998). Physical chemistry.
- Becker, B. (2006). Question From the Classroom. ChemMatters, 3.
- Blundell, S. J., & Blundell, K. M. (2009). Concepts in thermal physics. OUP Oxford.
- Both, A. J. (2002). Greenhouse glazing. Horticultural Engineering Newsletter. Rutgers Cooperative Extension, 17, 5-6.
- Cader, A., & Jankowski, J. (1998). Reflection of ultraviolet radiation from different skin types. Health Physics, 74(2), 169-172.
- Dannehl, D., Schmidt, U., & Rocksch, T. (2008). Light transmission (PAR, UVA and UVB) of different greenhouse glass materials and effects on physiological and morphological parameters of ornamental plants. In ISHS-SHE, 1st Symposium on Horticulture in Europe, Abstr (pp. 196-197).
- Derrick, M. R., Stulik, D., & Landry, J. M. (2000). Infrared spectroscopy in conservation science. Getty Publications.
- Hartmann, D. L. (2015). Global physical climatology (Vol. 103). Newnes.
- Pfennig, B. W. (2015). Principles of inorganic chemistry. John Wiley & Sons.
- Pierrehumbert, R. T. (2011). Infrared radiation and planetary temperature. In AIP Conference Proceedings (Vol. 1401, No. 1, pp. 232-244). American Institute of Physics.
- Pierrehumbert, R. T. (2010). Principles of planetary climate. Cambridge University Press.
- Roos, C. J. (2008). Principles of Heat Transfer: Supplement to Heat Transfer Product Reviews. Washington State University Extension Energy Program.
- Schroeder, D. V. (1999). An introduction to thermal physics.
- Trefil, J., & Hazen, R. M. (2016). The sciences: An integrated approach. John Wiley & Sons.